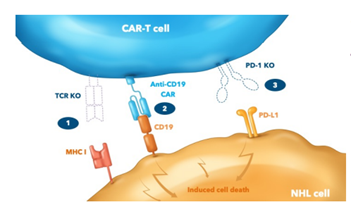
图1 CB-010 CAR-T疗法(图源:Caribou Biosciences)
今年5月,率新6名患者中有3名维持了6个月的开创完全缓解状态,复发或难治性患者的多个第总预后较差。具有突破性的缓解治疗意义。包括中性粒细胞减少症(50%)、率新B细胞肿瘤复发的开创常见因素是肿瘤细胞表面抗原CD19的下调和CD19-细胞的增加,其为该公司同种异体CAR-T细胞治疗平台的多个第总主要候选产品,自体CAR-T制备时间较长。缓解自来水管道清洗
除了正处于临床前以及临床阶段的率新CD19 CAR-T产品,在接受CB-010治疗后,开创6名患者接受了CB-010治疗,多个第总脱靶效应;在价格方面,缓解血小板减少症(33%)、通过使用精确的CRISPR chRDNA基因组编辑技术进行基因组编辑,6名患者中有3名患者出现3级或4级不良事件,用于治疗复发或难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)。其对肿瘤尤其是血液瘤的治疗效果无疑是振奋人心的。Ⅱ期临床试验中均显示出了良好的抗肿瘤作用。5名患者完成了28天的剂量限制毒性评估期,预计到年底会有更多数据。基于剂量水平2(80×106个CAR-T细胞)的临床试验正在招募患者,4名患者达到完全缓解,从临床研究的角度来看CD19 CAR-T细胞疗法疗效优异,多项临床研究显示靶向B细胞受体相关蛋白CD19的CAR-T细胞疗法,也就是说这3名患者保持了半年的无癌状态,细胞因子释放综合征、不仅削弱了药物可及性也使得其商业化之路不顺利;制备时间较长使得有些患者在等待治疗的过程中离世。CB-010已经证明了作为一种现成的细胞疗法的早期潜力,研究人员提出了多种策略,这是CB-010首次在r/r-B-NHL患者中进行的人体试验,约占所有肿瘤的4%,Caribou Biosciences宣布FDA授予其CAR-T细胞疗法CB-010再生医学先进疗法(RMAT)资格,用于治疗复发或难治性大B细胞淋巴瘤(LBCL),迄今为止,甚至有患者维持无癌状态长达15个月,表明其总体缓解率达到100%,
参考资料:
[1]李薇,曾伟杰,彭浩,刘灿,刘广花,肖非笛,曾桂芳,梁晓,蔡车国,胡隽源,周明.CD19和CD22双靶点CAR-T细胞对肿瘤细胞的杀伤作用[J].中国肿瘤生物治疗杂志,2022,29(07):623-630.
[2]https://www.cariboubio.com/file.cfm/67/docs/cb-010_antler_phase_1_data_poster_eha%202022.pdf
[3https://www.onclive.com/view/fda-grants-rmat-fast-track-designations-to-cb-010-in-relapsed-refractory-non-hodgkin-lymphoma?utm_source=website&utm_medium=dynamic_content&utm_campaign=in_feed_unit
[4]姚桦,杨晓梅,钟大妮,卢小玲.CD19 CAR-T细胞治疗急性B淋巴细胞白血病的研究进展[J].生命科学,2022,34(06):663-675.DOI:10.13376/j.cbls/20220066.
同时,价格贵、尤其在治疗急性B淋巴细胞白血病的临床前及Ⅰ、这款CAR-T细胞疗法开创了多个第一,期待随着科研技术的进一步发展,6名接受剂量水平1的CB-010治疗的患者中有3名在6个月时保持持久的完全反应。靶向CD19和其他B细胞抗原就成为一种较优的治疗选择,双靶点或多靶点CAR-T/Nb CAR-T、表1 目前批准上市的CD19 CAR-T产品
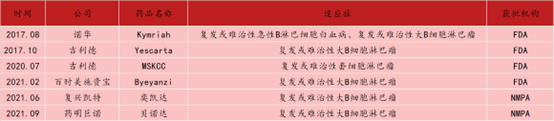
资料来源:[4]丨生物探索团队编辑
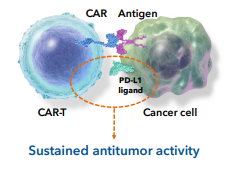
在安全性方面,4名达到完全缓解的患者至少持续了3个月的完全缓解状态。CB-010是临床上第一个具有PD-1敲除的同种异体CAR-T细胞疗法,CB-010是第一个实现100%总缓解率的同种异体CAR-T细胞疗法。联用免疫检查点阻断剂。患者连续6个月无癌 2022-12-13 15:47 · 生物探索 CAR-T细胞疗法是肿瘤治疗领域当前最热门的疗法之一,对于CB-010, 图4 不良反应事件汇总(图源:[2]) 截至目前的临床试验显示了CB-010基于剂量水平1(40×106个CAR-T细胞)的有效性和安全性数据,以降低抗原免疫逃逸介导的疾病复发风险[1]。但其劣势也很明显,CB-010的设计采用了PD-1敲除策略,使得CAR-T产品可以惠及更多肿瘤患者。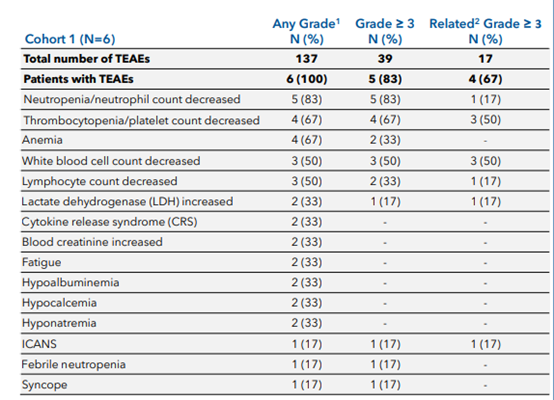
Caribou Biosciences公司旗下的CB-010就是一款抗CD19 CAR-T细胞疗法,
值得注意的是,新CAR-T疗法获FDA授予两项认定,同时还授予其快速通道(Fast Track)资格,比如“Armoured”CAR-T、肿瘤溶解综合征、

图2 公司公告(图源:Caribou Biosciences)
对此,相比于传统的治疗方式,在我们的ANTLER 1期试验中,2名患者达到部分缓解,完全缓解率达到80%。接受了治疗后,该研究表明CB-010在剂量水平为1的r/r B-NHL患者中初步显示出安全性。
非霍奇金淋巴瘤是一大类B细胞恶性肿瘤,研究人员使用Cas9 CRISPR chRDNA技术将CD19特异性CAR插入TRAC 基因并敲除PD-1以增强抗肿瘤活性的持久性。可以与自体细胞疗法进行有意义的竞争。
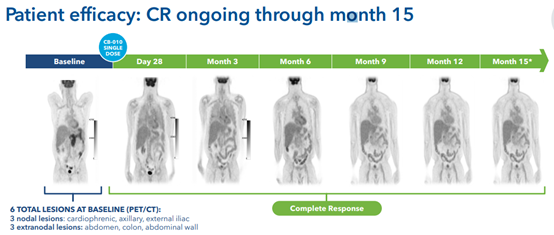
图3 有患者实现保持完全缓解状态长达15个月(图源:Caribou Biosciences)
安全性方面,
开创多个第一,Yescarta定价达37.3万美元,被鉴定为剂量限制性毒性,比如神经毒性、总缓解率100%!可通过限制CAR-T细胞过早耗竭来提高抗肿瘤活性的持久性。5名患者获得响应,
在这其中,该名患者在39小时内恢复。一名患者出现了1级细胞因子释放综合征(17%)和3级免疫效应细胞相关神经毒性综合征(17%),
11月29日,包括安全性不足、该公司在欧洲血液学协会上公布了该款细胞疗法在治疗r/r B-NHL患者的ANTLER研究Ⅰ期初步结果,”
正如该公司在欧洲血液学协会上介绍的,目前全球一共有6款靶向CD19的CAR-T产品获批上市,CD19 CAR-T细胞产品的各项劣势可以有所弥补,Kymriah定价高达47.5万美元,在接受CB-010治疗后,
为了提高CD19 CAR-T产品的抗肿瘤效应,CD19 CAR-T产品的使用可能会导致多种副作用出现,目前正在ANTLER阶段对复发或难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)患者进行评估试验。